アルミニウム1gに、ある濃さの塩酸を加え ていったとき発生する水素の体積は表のようになりました。
| 塩酸の体積(㎤) |
25 |
50 |
100 |
150 |
| 水素の体積(㎤) |
300 |
600 |
1200 |
1200 |
水素2㎤と酸素1㎤がちょうど反応し、液体の水ができるものとします。ある量の塩酸にアルミニウムを加 え、発生した水素をすべて集めて一 定量の酸素と反応させたとき、加えたアルミニウムの重さと反応後に残った気体の体積の関係は次のグラフのようになりました。グラフの P,Qにあてはまる数値と使用した塩酸の体積を答えなさい。
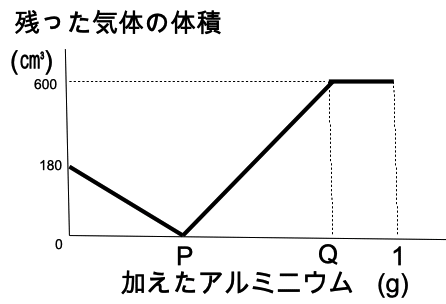
グラフからはじめの酸素は180㎤であ る。
P点では、発生した水素と一定量の酸素がちょうど反応して水になっている。その後発生した水素が増加してQ点で塩酸がな く なった。
| 塩酸 (㎤) |
アルミニウム(g) |
水素(㎤) |
||
| 100 |
+ |
1g |
→ |
1200 |
| ↓ |
↓ |
↓ |
||
| 80 |
+ |
0.8 |
→ |
600+360=960 |
1g×960/1200=0.8g・・・Q
100㎤×0.8/1=80㎤
P点では、180㎤×2=360㎤の水素が発生しているので、0.8g×360/960=0.3g・・・P
答え P=0.3、 Q=0.8 、80㎤