ある濃さの水酸化ナトリウム水溶液(A液)と塩酸(B液)とがあります。
いま、両方の体積の和が100㎤になるようにしながら混ぜ合わせ、水を蒸発させた後に残る個体の重さをはかりました。
その結果が次の表です。
| A液(㎤) | 10 |
30 |
50 |
70 |
90 |
| B液(㎤) |
90 |
70 |
50 |
30 |
10 |
| 後に残った個体(g) |
0.88 |
2.64 |
4.40 |
5.76 |
5.92 |
このとき、残った固体の重さのうち、30%が水酸化ナトリウムによるものでした。
この実験で用いたA液の体積は何㎤ですか。割り切れないときは分数で答えなさい。
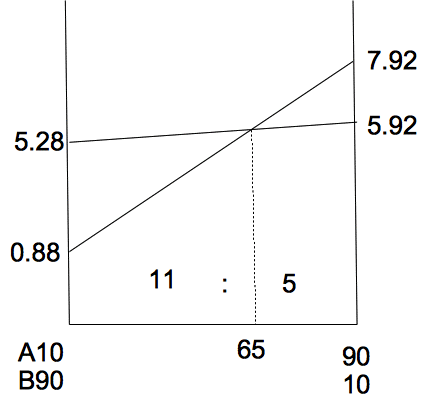
上のグラフのちょうちょ相似より、中和点はA液を65㎤加えたとき。
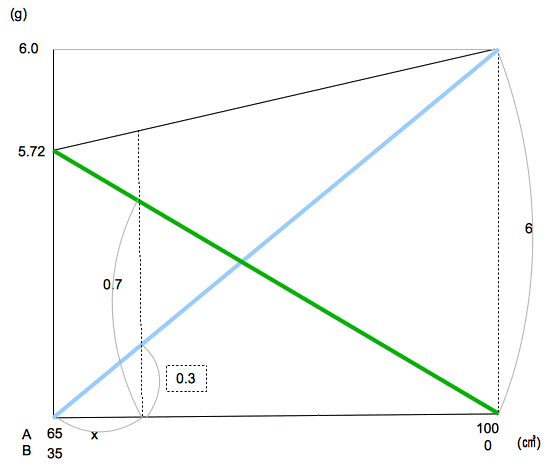
下のグラフは青が水酸化ナトリウム、緑が食塩の固体の重さ。
6×X/35:5.72×(35−X)/35=3:7 となる。
これより、X=17.16×35÷ 59.16
これに65をたして、37050/493㎤となる。
答え 37050/493㎤