ある濃さの塩酸(A液)にマグネシウム1gまたはアルミニウム0.75gを加えると、金属はすべて溶け、水素が1L発生した。同様に ある 濃さの水酸化ナトリウム水溶液(B液)にアルミニウム0.75gを加えると、水素が1L発生した。
また、ある重さのアルミニウムにA液を300㎤注ぐと、水素が12L発生し、後にアルミニウムが残った。
次に、A液300㎤にいろいろな量のB液を加えてできた液に、マグネシウムとアルミニウムが一定の割合で均一に混ざった混合粉末Pを 加え ると、発生した水素の体積はグラフの通りになった。
グラフのXにあてはまる数値を答えなさい。
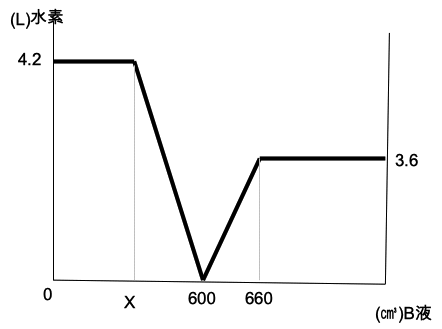
はじめグラフが水平になっているのは、A液とB液が部分中和していて、残りのA液が金属を溶かして水素を発生させている。X ㎤の B液 を加えたときは、金属を溶かしたA液と、B液と中和したA液がそれぞれ過不足なく反応し終わった状態を示している。
グラ フの右下がりの部分では、中和しき れなかったA液が金属を溶かして水素を発生させている。
600㎤のB液と300㎤のA液はちょうど中和している。
グラフのその後の部分では、B液が金属を溶かして水素を発生させている。
グラフのそれぞれの部分で、式を作り比例関係を使って、赤字、青字部 分を求める。
| 水酸化ナトリウム水溶液B | + | アルミニウム | → | 水素 |
| 0.75g | 1.0L | |||
| ↓ |
↓ |
|||
| 660−600=60㎤ | 2.7g | 3.6L |
| 塩酸A | + | アルミニウム | → | 水素 |
| 0.75g | 1.0L | |||
| ↓ |
↓ |
|||
| 300㎤ | 9.0g | 12.0L | ||
| ↓ |
↓ |
|||
| 90㎤ | 2.7g | 3.6L |
| 塩酸 A | + | マグ ネシウム | → | 水素 |
| 1.0g | 1.0L | |||
| ↓ |
↓ |
|||
| 300 ㎤ | 12.0g | 12.0L | ||
| ↓ |
↓ |
↓ |
||
| 15㎤ | 0.6g | 0.6L |
以上 より、300−(15+90)=195㎤の A液 に、 水酸化ナトリウム水溶液Bがちょうど中和したことが分かる。
| 塩酸 A | + | 水酸 化ナトリウム水溶液 B | → | 中和 |
| 300 ㎤ | 600 ㎤ | |||
| ↓ |
↓ |
|||
| 195㎤ | 390㎤ |
答え X=390