墫巁偵悈巁壔僫僩儕僂儉偺屌懱傪壛偊傞偲丄悈巁壔僫僩儕僂 儉偑梟偗傞偲偒偵敪惗偡傞梟夝擬偵壛偊丄拞榓擬偲屇偽傟傞拞榓斀墳偵傛傞擬偑敪惗偟丄偙偺俀庬椶偺擬偵傛傝梟塼偺壏搙偑忋偑傝傑偡丅
偨偩偟丄敪惗偟偨擬偼丄梟塼偺壏搙傪忋偘傞偨傔偩偗偵巊傢傟丄梟塼侾㎤偺壏搙傪侾亷忋偘傞偨傔偵昁梫側擬偼偮偹偵堦掕偱偁傞傕偺 偲偟 傑偡丅
傑偨丄悈傗墫巁偵悈巁壔僫僩儕僂儉偺屌懱傪壛偊偰傕梟塼偺懱愊偼曄傢傜側偄傕偺偲偟傑偡丅
丂丂摨偠壏搙偺墫巁100㎤偵偄傠偄傠側廳偝偺悈巁壔僫僩儕僂儉偺屌懱傪壛偊偰斀墳偝偣偨偺偪丄梟塼偺壏搙傪偟傜傋傞偲壓偺昞偺 傛偆 偵側偭偨丅
偙偺偲偒丄偄偢傟偺応崌傕悈巁壔僫僩儕僂儉偺屌懱偑梟偗巆傞偙偲偼側偐偭偨丅
| 悈巁壔僫僩儕僂儉偺屌懱(g) |
2 |
4 |
6 |
8 |
10 |
| 梟塼偺壏搙(亷) |
32.0 | 44.0 | 51.8 | 56.8 | 61.8 |
墫巁100㎤偵悈巁壔僫僩儕僂儉悈梟塼傪壗㎤壛偊傞偲丄梟塼偺忋徃壏搙偑4亷偵側傝傑偡偐丅2捠傝 摎偊側 偝偄丅偨偩偟墫巁偲悈巁壔僫僩儕僂 儉悈梟塼偼懱愊斾侾丗侾偱拞榓偟丄偙偺偲偒敪惗偟偨擬偼拞榓擬偺傒偱偁傞傕偺偲偡傞丅
傑偢拞榓揰傪媮傔傞丅
昞偱偼屌懱偑俀g乣係g偺偲偒壏搙偑12亷忋徃偟丄屌懱偑6g~10g偺偲偒2g偁偨傝5亷忋徃偟偰偄傞偺偱丄屌懱偑4g~6g 偺娫 偵拞榓揰偑偁傞偼偢丅壓偺僌儔僼傛傝屌懱偑4.8g偺偲偒拞榓偟丄偙偺偲偒梟塼偺壏搙偑48.8亷偱偁傞偙偲偑傢偐傞丅
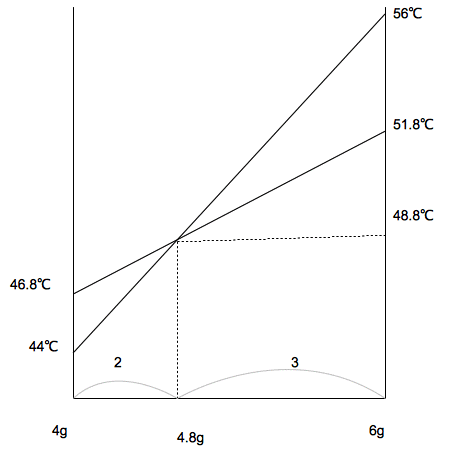 拞榓偑懕偄偨応崌偺僌儔僼偲梟夝擬偺傒敪惗偟偨応崌偺僌儔僼偺岎揰
偑拞榓揰偲側傞丅
拞榓偑懕偄偨応崌偺僌儔僼偲梟夝擬偺傒敪惗偟偨応崌偺僌儔僼偺岎揰
偑拞榓揰偲側傞丅(46.8亅44)丗(56亅51.8)亖2丗3
(侾) 悈巁壔僫僩儕僂儉悈梟塼偑梋傞応崌
昞傛傝丄梟夝擬偺傒偵傛傞忋徃亄5亷/2g偲側傞偺偱悈僫屌懱2g偺偲偒偺拞榓擬偵傛傞忋徃亖12亷亅5亷亖7亷 /2g 偲側傝丄壓偺昞偺傛偆偵側傞丅
悈僫偺屌懱(g)
0
2
4
4.8
6
8
10
梟塼偺壏搙乮亷)
20.0
32.0
44.0
48.8
51.8
56.8
61.8
梟夝擬偵傛傞忋徃壏搙(亷)
0
5.0
10.0
12.0
15.0
20.0
25.0
拞榓擬偵傛傞忋徃壏搙(亷)
0
7.0
14.0
16.8
16.8
16.8
16.8
傛偭偰丄 ⬜︎亖420亅100亖320㎤
墫巁侾侽侽㎤丂丂亄丂丂悈僫悈100㎤(悈僫屌懱4.8g) 丂丂仺丂丂拞榓擬偵傛傞忋徃壏搙16.8亐2亖8.4亷丂丂丂丂丂丂梟塼憤検200㎤
墫巁侾侽侽㎤丂丂丂丂丂丂丂悈僫悈⬜︎㎤丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂 丂丂丂拞榓擬偵傛傞忋徃壏搙8.4亷亐4亷亖2.1丂丂丂丂梟塼憤検200亊2.1亖係俀侽㎤
(2) 墫巁偑梋傞応崌
墫巁嘆㎤偲悈僫悈嘆㎤偑斀墳偟偰係亷忋徃偟偨丅
仺悈梟塼偺憤検偵懳偡傞墫巁偺斾偼丄嘆丗(100亄嘆)偲側傞丅
偙傟偑(1)偺偲偒偺妱崌侾侽侽㎤丗420㎤偵摍偟偄偺偱丄
嘆丗(100亄嘆)亖侾侽侽㎤丗420 ㎤
偙傟傛傝丄320亊嘆亖10000
嘆亖31.25㎤