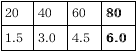[中学受験理科ー水溶 液] 中学受験プロ家庭教師のページへ
![]() うすい塩酸A160gの入ったビーカーをいくつ
か用意して、それらにあるこさの水酸化ナトリウム水溶液Bを加えました。そのあと、そのまぜあわせた水溶液をあたためて水を蒸発さ
せ、あとに残った固体の
重さを測りました。加えた水酸化ナトリウム水溶液Bと水の蒸発後に残った固体の重さを表にまとめました。これについて、次の問いに答
えなさい。
うすい塩酸A160gの入ったビーカーをいくつ
か用意して、それらにあるこさの水酸化ナトリウム水溶液Bを加えました。そのあと、そのまぜあわせた水溶液をあたためて水を蒸発さ
せ、あとに残った固体の
重さを測りました。加えた水酸化ナトリウム水溶液Bと水の蒸発後に残った固体の重さを表にまとめました。これについて、次の問いに答
えなさい。
水酸化ナトリウム水溶液Bの重さ (g) |
|
|
|
|
|
|
|
|
|
(1) 水酸化ナトリウム水溶液Bのこさは何%ですか。
(2) 塩酸160gと何gの水酸化ナトリウム水溶液を混ぜ合わせると食塩水だけになりま すか。
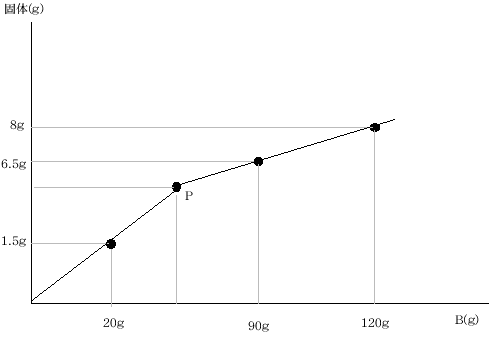
(3) 水酸化ナトリウム水溶液B160gの入ったビーカーをいくつか用意して、それらに 塩酸Aを 加えました。そのあと、そのまぜあわせた水溶液をあたためて水を蒸発させ、あとに残った固体の重さを測りました。横じくに加えた 塩酸の重さを、たてじくに 水の蒸発後に残った固体の重さをとってグラフをかきなさい。
(4) 塩酸Aにその3倍の重さの水を加えた塩酸Cをつくりました。水酸化ナトリウム水溶 液 B50gと塩酸C160gを混ぜ合わせたあと、あたためて水を蒸発させるとき、あとに残る固体の重さを求めなさい。
(5) 塩酸A160gに水を加えて塩酸Dをつくりました。水酸化ナトリウム水溶液 B40gと塩酸 D60gを混ぜ合わせたあと、あたためて水を蒸発させ、あとに残った固体の重さを測ると3gでした。塩酸A160gに何gの水を 加えて塩酸Dをつくりまし たか。考えられる最大の重さを答えなさい。
解 説
水ナ水B 塩酸 固体
20g
160g
1.5g
ア
90g
160g
6.5g
イ
120g
160g
8.0g
ウ