解説
中
和反応では、部分中和のとき、含まれる物質は食塩と水酸化ナ トリウムです
が(水を蒸発させて残る固体)その内訳がわかりません。ただ中和反応がどの程度進んでいるかは、中和点に達するまでであれば、増えた
固体の重さに比例する ことが使えます。
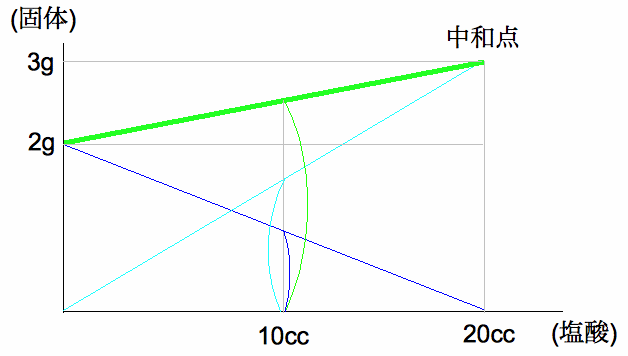
この問題でも、塩酸10ccで固体は、2.5-2=0.5g増えて、さらに中和点では3-2.5=0.5g増えているので、加えた塩
酸15cc中10cc が中和に使われたことがわかります。のこり5ccの塩酸で酸性を示すことになります。
つまり20ccの塩酸で完全中和して、3gの食塩ができたので、10ccの塩酸では1.5gの食塩ができたことになります。下図で、
水色の線が食塩の量で
加えた塩酸に比例して増えます。青線は水酸化ナトリウムの量で中和が進むにつれて減って行きます。緑の線がその時の固体の量で、食塩
と水酸化ナトリウムの 合計量となります。

考察
中和によって、水酸化ナトリウムは減り、食塩は増えます。差し引きで塩酸10ccあたり0.5g増
えます。固体の重さの増加量が
2倍3倍となれば、それに
つれて中和反応も2倍3倍起こっているということですね。上のグラフごとしっかりと記憶にきざみこんでおきましょう。
最近では大阪星光に出題されていました。水溶液は難問の宝庫ですが、敬遠せずにたくさんの問題に挑戦しましょう。